La alcalinidad del agua
La alcalinidad es la capacidad del agua para neutralizar la acidez. Se refiere a la presencia de carbonatos (CO32-), bicarbonatos (HCO3–) e hidróxidos (OH–). Se expresa en mg/L (ppm) de carbonato de calcio (CaCO3). También se conoce como «la capacidad amortiguadora del agua», ya que le da al agua la capacidad para resistir los cambios de pH tras la adición de ácido.
Alcalinidad = HCO3– + CO32- + (OH–)
La alcalinidad suele ser el resultado de la meteorización de rocas carbonatadas y la disolución de dióxido de carbono atmosférico. Una vez que se agrega ácido al agua que contiene alcalinidad, los iones de hidrógeno del ácido reaccionan principalmente con las especies de carbonato.
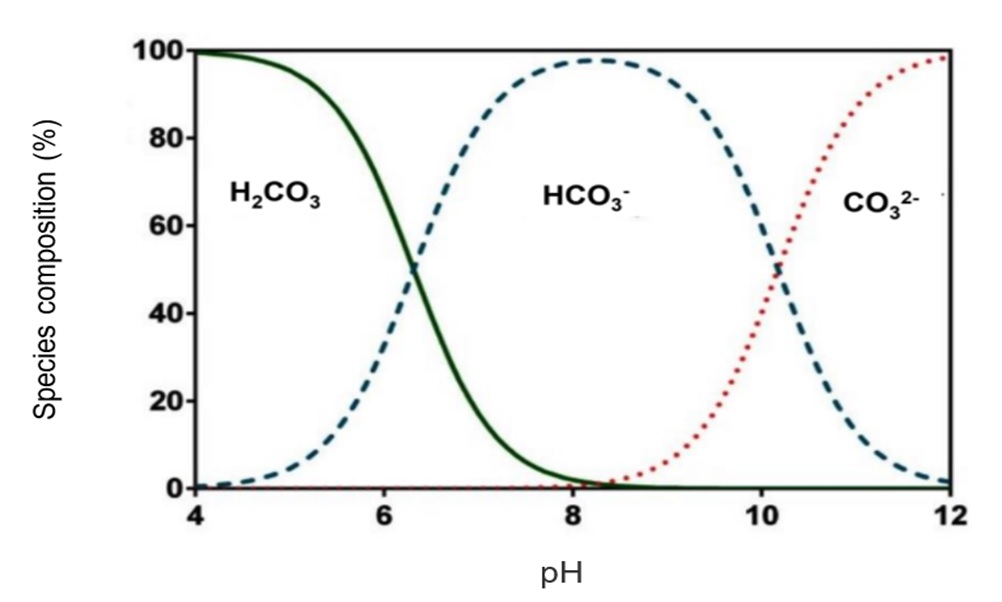
H2CO3 ↔H+ + HCO3– pH = 6,37 + log (HCO3– / H2CO3)
HCO3– ↔ H+ + CO32- pH = 10,33 + log (CO32- / HCO3–)
Como puede verse en la figura anterior, los carbonatos (CO32-) existen en el agua a un pH superior a 8,3. A un pH de 4,3 la alcalinidad total es igual a cero. Todos los bicarbonatos se convierten en ácido carbónico y el agua ya no tiene capacidad amortiguadora.
Por lo tanto, cuanto mayor sea la alcalinidad, más ácido se requiere para bajar el pH del agua.
Una vez que se consumen las especies carbonatadas, cualquier adición de ácido resultará en un cambio inmediato del pH, ya que los iones de hidrógeno, aportados por el ácido, permanecen libres en la solución.
Por ejemplo, comparemos las siguientes dos fuentes de agua:
Fuente de agua 1: pH 6,5, 120 mg / L HCO3–
Fuente de agua 2: pH 7,5, 80 mg / L HCO3–
¿Cuál de las fuentes de agua requiere más ácido para bajar el pH a 5,5?
Intuitivamente, se diría que la fuente de agua 2 requiere más ácido porque su pH es más alto.
Sin embargo, se puede ver en las curvas de titulación a continuación que la fuente de agua 1 requiere más ácido para reducir su pH al nivel deseado. La razón de esto es que el mayor nivel de bicarbonatos en la fuente de agua 1 resulta en una mayor capacidad amortiguadora, por lo que es más resistente a los cambios de pH.